Блоттінг(Від англ. " blot- пляма) - перенесення НК, білків і ліпідів на тверду підкладку, наприклад, мембрану та їх іммобілізація.
- електрофорез у поліакриламідному гелі: o в денатуруючих умовах з додаванням сечовини - поділ коротких одноланцюгових ПК;
- ізоелектрофокусування - для поділу білків по ізоелектричній точці (pI);
- двовимірний (2D) електрофорез - для поділу білків у двох напрямках - по изоэлектрической точці та молекулярної масі;
- електрофорез в агарозному гелі - розподіл НК: o за довжиною лінійних фрагментів;
- тонкошарова хроматографія - поділ ліпідів із ліпідних комплексів.
o в умовах денатурування з додаванням натрію додецилсульфату (електрофорез по Леммлі) - поділ білків по молекулярній масі;
o в нативних умовах - поділ білків за тривимірною структурою;
o по "суперспіралізації" кільцевих молекул;
- дифузія молекул - повільне перенесення, часто застосовується для ліпідів;
- капілярний блот - мембрана притискається до гелю, поверх неї кладеться стопка фільтрувального паперу, буфер для перенесення зволожує гель і піднімається під дією капілярних сил, змочуючи фільтрувальний папір і переносячи макромолекули з гелю на мембрану; капілярний блот може здійснюватися: o в камерах із зволоженням гелю буфером - "напівсухим" переносом;
- вакуумний блот - аналогічний капілярному блот, але перенесення прискорюється за рахунок використання вакууму замість капілярних сил, створюваних при змочуванні фільтрувального паперу;
- електроблот - перенесення заряджених макромолекул на мембрану відбувається під дією електричного струму;
- "пришивання" ПК до мембрани під дією УФ-опромінення або нагріву - для остаточного закріплення на нейлонових мембранах;
- дот-блот (слот-блот) - нанесення зразка проводиться у вигляді точки або рисочки безпосередньо на мембрану без попереднього поділу молекул в гелі або на ТСХ-пластині.
o в камерах із зануренням гелю в буфер;
- PVDF-мембрани (полівініліденфторидні);
- NC-мембрани (нітроцелюлозні);
- нейлонові мембрани (застосовуються для ПК).
- фарбування - зв'язування барвника (іонів срібла, Кумассі, Понсо, етидія бромистого) безпосередньо з макромолекулами, що детектуються;
- імунохімічне мічення - мічення макромолекул відбувається за рахунок мічених антитіл, що специфічно зв'язуються з ними, детекція здійснюється: o імунофарбуванням - антитіла мітяться барвниками, реєструється поглинання світла певної довжини хвилі;
- радіаційне мічення - в макромолекули вводяться радіаційні мітки (радіоізотопи), детекція здійснюється за допомогою: o авторадіографії (накладенням на мембрану фотоплівки);
- гібридизація - зв'язування нуклеїнових кислот міченими олігонуклеотидами з комплементарною структурою, детекція, як правило, здійснюється реєстрацією випромінювання радіаційного випромінювання або флуоресценції мітки;
- мас-спектрометрія – використовується для прямого структурного аналізу ліпідів.
o імуноферментно - антитіла мітяться ферментом, реєструється кількість забарвленого продукту, напрацьованого в ході ферментативної реакції (ІФА);
o хемілюмінесцентно - антитіла мітяться репортерним ферментом, який у присутності субстрату випромінює свічення, реєструється випромінювання світла
певної довжини хвилі;
o флуоресцентно - антитіла мітяться флуоресцентною міткою, яка збуджується світлом певної довжини хвилі, реєструється випромінювання світла в
більш довгохвильової області;
o радіоімаджинга (кількісного визначення радіаційної емісії та побудови картини взаємного розташування міток);
- Саузерн-Блоттінг(Блоттінг за Саузерном) - на прізвище Едвіна Саузерна, який запропонував метод - визначення послідовності ДНК у зразку та визначення кількості копій генів у геномній ДНК. Перенесення на мембрану передує розщеплення зразка ендонуклеазами рестрикції на фрагменти та їх фракціонування електрофорезом в агарозному гелі. Аналіз на мембрані здійснюється гібридизацією із міченими олігонуклеотидами відомої послідовності;
- нозерн-блот- Визначення послідовності РНК у зразку та вивчення генної експресії (визначення мРНК). Аналогічний блот по Саузерну, але досліджуються виділені зі зразка молекули РНК, без розщеплення ендонуклеазами. Поділ молекул проводять в агарозному гелі з додаванням формальдегіду (для денатурації РНК) або поліакриламідному гелі з додаванням сечовини (застосовується для аналізу мікроРНК). Іммобілізація молекул РНК на мембрані відбувається за рахунок нагрівання під вакуумом або "пришивання" за допомогою УФ-опромінення;
- вестерн-блот- білковий імуноблот - аналітичний метод, що використовується для визначення специфічних білків у зразку. Перенесення на мембрану передує поділ білків у поліакриламідному гелі. Аналіз білків на мембрані здійснюється імунохімічно;
- фар-вестерн блот- білковий блот, використовується для визначення білок-білкових взаємодій, аналогічний вестерн-блот, але замість антитіл використовуються інші білки, що специфічно зв'язуються з досліджуваним білком;
- соузвестерн-блот- визначення білків, що зв'язуються з ДНК, та сайтів у молекулах ДНК, з якими зв'язуються білки; Як пробу використовують мічені фрагменти ДНК різної довжини, отримані розщепленням більшого досліджуваного фрагмента геномної ДНК. Зв'язувальні молекули ДНК потім вимиваються з кожного комплексу білок-ДНК і аналізуються електрофорезом поліакриламідному гелі;
- істерн-блот- Визначення посттрансляційних модифікацій білків (пов'язаних з ними ліпідів, глікополісахаридів, фосфатних залишків) - аналогічний вестерн-блот, але використовуються антитіла не до білків, а до ліпідів, глікополісахаридів і т.д. Також як проб використовуються крім антитіл інші білкові молекули, що зв'язуються з досліджуваними (наприклад, лектин);
- фар-істерн-блот- аналіз ліпідів, розділених високоефективною тонкошаровою хроматографією. Перенесення на мембрану, зазвичай, здійснюється з допомогою дифузії. Реєстрація здійснюється прямим мас-спектрометричним структурним аналізом.
Вестерн – блот(іноді званий імуноблот білок) є широко використовуваним аналітичним методом використовується в молекулярній біології, імуногенетики та інших молекулярної біології дисциплін для визначення специфічних білків у зразку гомогенату тканини або екстракту.
Коротко зразок піддають денатурації білка, а потім гель - електрофорезу. Синтетичні або тваринного походження антитіла (відомий як первинне антитіло) , що створюється розпізнає і зв'язується зі специфічним білком - мішенню. Електрофорез мембрану промивають у розчині, що містить первинне антитіло, перед тим надлишок антитіла змивається. Вторинне антитіло додають, який розпізнає та зв'язується з первинним антитілом. Вторинне антитіло візуалізували за допомогою різних методів, таких як фарбування, імунофлюоресценції, а також радіоактивності, що дозволяє непряме виявлення специфічного білка - мішені.
Інші споріднені методи включають дот-блот аналіз, кількісну дот-блоту, імуногістохімічну та імуноцитохімію, де антитіла використовуються для виявлення білків у тканинах і клітинах імунної мітки та імуноферментний аналіз (ELISA).
Назва вестерн - блотце гра на eponymously назвою Southern-блот, методика ДНК виявлення розроблений раніше Edwin Southern. Крім того, виявлення РНК називають північним ляпкою і був розроблений Джеймсом Alwine, Девід Кемп і Джордж Старк в Стенфорді. Термін "вестерн - блот" був дано в техніці У. Ніл Бернетт, хоча сам метод виник у лабораторії Гаррі Towbin в .
Програми
Вестерн - блот широко використовується в біохімії для якісного визначення одиночних білків та білків-модифікацій (наприклад, посттрансляційної модифікації). Він використовується як загальний метод, щоб визначити наявність певного одного білка в складній суміші білків. Напівкількісна оцінка білка може бути отримана з розміру та кольору інтенсивності смуги білка на блот – мембрані. Крім того, застосування серії розведень очищеного білка відомих концентрацій може бути використане, щоб дозволити більш точну оцінку концентрації білка. Вестерн-блот зазвичай використовується для перевірки продукції білка після клонування. Він також використовується у медичній діагностиці, наприклад, у тесті на ВІЛ або BSE-TEST.
Підтверджуючий тест на ВІЛ використовує вестерн – блот для виявлення анти-ВІЛ антитіла в організмі людини у сироватці зразка. Білки з відомих ВІЛ-інфікованих клітин розділені та нанесені на мембрану, як описано вище. Потім сироватка для тестування застосовується на стадії інкубації первинного антитіла; вільне антитіло вимиває, а вторинне антитіло проти людського пов'язане з сигналом ферменту додається. Забарвлені смуги потім показують білки, яких сироватка пацієнта містить антитіло.
Західний блот також використовуються як остаточний тест для Крейтцфельда-Якоба, типу захворювання пріона, пов'язаного із споживанням забрудненої яловичини від великої рогатої худоби з бичачою губчастою енцефалопатією (BSE, зазвичай згадуються як «коров'ячий сказ»).
Інше застосування у діагностиці туляремії. Оцінка здатності вестерн-блот виявлення антитіл проти F. tularensis показав, що його чутливість становить майже 100%, а специфічність 99,6%.
колориметричне виявлення
Метод виявлення колориметричного залежить від інкубації вестерну - блот з субстратом, який взаємодіє з ферментом - репортером (наприклад, пероксидаза), який пов'язаний з вторинним антитілом. Це перетворює розчинний барвник на нерозчинну форму іншого кольору, який випадає в осад поруч із ферментом і, таким чином, забарвлює мембрану. Розвиток блото потім зупиняє вимивання розчинної барвник. Рівні білка оцінювали за допомогою денситометрії (як інтенсивна пляма) або спектрофотометрії.
Хемілюмінесцентне виявлення
Хемілюмінесцентні методи виявлення залежить від інкубації вестерн - блот з субстратом, який люмінесцуватиме при впливі репортера на вторинного антитіла. Світло потім детектується ПЗС - камер, які захоплюють цифрове зображення на вестерн - блоттингу або фотоплівки. Використання плівки для виявлення Вестерн - блот поступово зникає через відсутність лінійності зображення (не точної кількісної оцінки). Зображення аналізується за допомогою денситометрії, який оцінює відносну кількість білка фарбування та кількісні результати з точки зору оптичної щільності. Наступне програмне забезпечення дозволяє подальший аналіз даних, такі як аналіз молекулярної ваги, якщо використовуються відповідні стандарти.
Що таке вестерн-блот?
Ідентифікація білка в складних сумішах або екстрактах різних тканин є одним з найпоширеніших завдань. Використовуючи такий інструмент як специфічні антитіла, можна визначити білок, що досліджується, з мінімумом тимчасових і фінансових витрат.
У методі Вестерн-блот (Western blotting) на першому етапі суміш білків розділяється методом електрофорезу в присутності додецилсульфату натрію (ДСН), потім переноситься на нітроцелюлозну мембрану методом електроблот. Суть даного методу полягає в тому, що гель після електрофорезу міститься на нітроцелюлозну мембрану між шарами фільтрувального паперу. Зібраний таким чином «сендвіч» поміщається в електричне поле так, що комплекси білок-ДСН рухаються впоперек пластини гелю та іммобілізуються (внаслідок неспецифічної сорбції) на поверхні нітроцелюлозної мембрани.
У зв'язуванні комплексу білок-ДСН із нітроцелюлозною мембраною беруть участь в основному сили електричної природи, причому дана взаємодія є багатоточковою і призводить до «розпластування» білків на поверхні мембрани. Таким чином, після електроперенесення ми отримуємо на нітроцелюлозі репліку гелю з білками, розташованими так само, як у поліакриламідному гелі.
Після проведення ДСН - електрофорезу, електроперенесення та сорбції білків з гелю на нітроцелюлозну мембрану третинна конформація білка сильно змінена, якщо взагалі правильно говорити про існування третинної структури для білка після такої жорсткої обробки. Тому для імунохімічної детекції білка, що досліджується, зазвичай використовуються тільки моно- або поліклональні антитіла, специфічні до лінійних ділянок білкової молекули. Антитіла, специфічні до конформаційних епітопів (або ділянках, що включають міжсуб'єдиничні контакти), як правило, не придатні для використання в методі Вестерн-блот.
Після перенесення білків мембрану послідовно інкубують з антитілами, специфічними до досліджуваного білка, а потім з вторинними антитілами, специфічними до Fc-фрагментів первинних антитіл, кон'югованими з ферментної (або будь-якої іншої) міткою (рис. 1 А). У випадку, коли з міткою кон'юговані безпосередньо первинні, специфічні до антитіла досліджуваного антитіла, вторинні антитіла не потрібні (рис. 1 Б). Імунні комплекси, що утворилися в місці локалізації досліджуваного білка, «проявляються» за допомогою хромогенного субстрату (залежить від типу мітки).
Чутливість та специфічність методу сильно залежать від того, які антитіла використовуються при проведенні досліджень. Використовувані антитіла мають бути специфічні до унікальної, характерної лише досліджуваного білка послідовності амінокислот. В іншому випадку можлива взаємодія (особливо у разі грубих білкових екстрактів) антитіл з кількома білковими молекулами, що у свою чергу призведе до появи на мембрані кількох пофарбованих смуг. Ідентифікація досліджуваного білка у разі часто буває скрутною чи взагалі неможливою.
Другим важливим фактором, про який слід пам'ятати при виборі антитіл є афінітет. Чим вищий афінітет антитіл, тим яскравіше і чіткіше фарбуються білкові смуги, тим вище чутливість методу. При використанні високоафінних антитіл можна досягти чутливості 1 нг і навіть вище.
Для візуалізації результату взаємодії пов'язаного з мембраною антигену та антитіл використовують вторинні антитіла, кон'юговані з агентами, здатними за певних умов давати певний сигнал. Зазвичай як такий агент використовують фермент (пероксидазу або фосфатазу), продукт реакції якого має забарвлення і випадає на мембрані у вигляді нерозчинного осаду. Також у цьому методі можливе використання флуоресцентних міток.
Мал. 1. Схема імунохімічного фарбування білка, що досліджується: А - з використанням вторинних антитіл, кон'югованих з ферментною міткою; Б - первинне антитіло безпосередньо кон'юговано з ферментною міткою.
Протокол:
I. Підготовка гелю та мембрани та електроперенесення білків
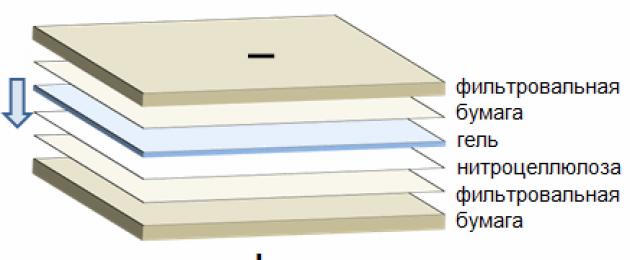
Поліакриламідний гель після проведення електрофорезу поміщають у ванну з буфером для блот (25 мМ Трис, рН 8,3, 192 мМ гліцин, 10% етанол). Два аркуші фільтрувального паперу, вирізані за формою касети для блот, змочені буфером для блот, поміщають на ту частину касети, яка буде звернена до анода. Потім на фільтрувальний папір поміщають попередньо змочену тим же буфером нітроцелюлозну мембрану, стежачи за тим, щоб між мембраною та папером не було бульбашок повітря. Після цього на мембрану слід обережно помістити гель, знову звернувши особливу увагу на відсутність бульбашок повітря між гелем та мембраною. Завершують формування сендвіча два шари змоченого фільтрувального паперу, що поміщаються на поверхню гелю (Рис. 2). Отриманий сендвіч затискається в касеті та поміщається між електродами так, щоб мембрана була звернена до анода.

Мал. 2. Схема електроперенесення білків на мембрану.
ІІ. Електроперенесення
Електроперенесення білків на нітроцелюлозну мембрану проводять у буфері, що містить 25 мМ Трис, рН 8,3, 192 мМ гліцин, 10% етанол протягом 30-50 хв при постійній напрузі 100 В. Час електроперенесення залежить від розміру білків, що переносяться, тим довше здійснюється електроперенесення. Якість електроперенесення та розташування білкових смуг оцінюють, забарвлюючи нітроцелюлозну мембрану 0,3% розчином Ponceau S в 1% оцтовій кислоті. Перед проведенням імунохімічного фарбування мембрану слід промити кілька разів слабко лужним водним розчином Трис для видалення барвника, що зв'язався з білками.
ІІІ. Імунохімічне фарбування білків, іммобілізованих на нітроцелюлозній мембрані
Для блокування місць неспецифічного зв'язування антитіл мембрану інкубують при постійному перемішуванні при кімнатній температурі протягом 30 хв PBST (для кращого блокування можна використовувати розчин PBST, що містить 10% сухе знежирене молоко). Після блокування мембрану інкубують протягом години при кімнатній температурі та постійному перемішуванні PBST, що містить 1-10 мкг/мл специфічних антитіл. Оптимальна концентрація антитіл підбирається емпірично і залежить від афінності взаємодії антитіл з антигеном. Після закінчення інкубації мембрану промити 5 разів PBST і перенести до розчину вторинних антитіл, кон'югованих з пероксидазою хрону. Розведення кон'югату зазвичай вказується виробником на упаковці або підбирається дослідником емпірично. У розчині вторинних антитіл мембрану інкубувати 1:00 при постійному перемішуванні.
Після ретельного відмивання (мінімум 5 - 6 разів змінювати буфер) PBST мембрану переносять у розчин хромогенного субстрату, що містить 3 мг диаминобензидина (ДАБ) та 10 мкл 30% перекису водню в 10 мл 0.1 М трис-HCl, рН 7,6. Інкубацію проводять при перемішуванні 5-10 хвилин. Мембрану після закінчення інкубації з субстратом слід промити PBST, підсушити, промокнувши фільтрувальним папером, і відразу зробити електронну копію, скануючи в кольорі. Якщо мембрана повністю висихає, профарбовані білкові смуги бліднуть, і зображення виходить менш яскравим та контрастним.
Примітка: ДАБ є токсичною речовиною та потенційним канцерогеном. Працювати лише у гумових рукавичках!
Вестерн Блоттінг
Професор кафедри біохіміїта молекулярної біології,
Д.М.Н. Спіріна Людмила
Вікторівна
Вестерн Блоттінг
Визначення. Вестерн-Блоттінг
(Вестерн-блот,
аналітичний
метод,
використовується для
визначення
специфічних
білків у зразку.
Визначення. Вестерн-блот (вестерн-блот, білковий імуноблот, Western bloting)
Визначення. Вестерн-Блоттінг(Вестерн-блот,
білковий імуноблот, Western bloting)
Вестерн-блот був розроблений у лабораторії
Джорджа Старка (Стенфорд, Великобританія)
Назва вестерн-блот було надано техніці У.
Нейлом Бурнеттом і є грою слів від
назви Саузерн Блоттінг (Southern blotting). методики визначення ДНК, розробленої
раніше Едвіном Саузерном
Вестерн-блот був розроблений в лабораторії Джорджа Старка (Стенфорд, Великобританія)
Western Blotting –метод визначення
білків
Саузерн Блоттінгметодики
визначення ДНК,
розробленою
раніше Едвіном
Саузерний Southern
blotting).
Аналогічний метод
визначення РНК
називається Нозерн
Блоттінг (Nothern
blotting).
Детекція
посттрансляційних
модифікацій білків
називається Істерн
Блоттінг (Eastern
blotting).
протокол. ПРОТОКОЛ
ПРОТОКОЛ1. Поділ білків
методом SDS-PAGE гельелектрофорезу/
За допомогою гель-електрофорезу
білки поділяються на
поліакриламідному гелі.
2. Перенесення білків на
мембрану
3. Блокування та Детекція
Потім їх детектують з
використанням антитіл:
спочатку білки зв'язуються з
первинними (моно-або
поліклональними) антитілами,
які в свою чергу
зв'язуються
з вторинними антитілами,
кон'югованими з ферментами
(пероксидазою хрону або
лужною фосфатазою).
протокол. Вестерн-блот можна виявляти антиген в кількостях менше 1нг.
протокол.Вестерн-блот можна виявляти
антиген у кількостях менше 1нг.
4. Візуалізація.
Високий ступінь
дозволу досягається за
рахунок електрофоретичного
поділу білків та
специфічності
моноклональних антитіл.
Візуалізація
досліджуваного білка
досягається шляхом
проведення
відповідної
біохімічної реакції з
освітою продукту,
який визначається
колориметричним, хемілюмінесцентним,
флюоресцентними методами
детекції.
5. Аналіз.
Кількість білка оцінюється зза допомогою денситометрії.
Southern Blotting Цим методом виявляють унікальні фрагменти ДНК, розмір яких становить приблизно одну мільйонну частину геном
Геномну ДНК (зазвичайвиділену з
лейкоцитів чи клітин
плоду) розщеплюють на
короткі фрагменти,
поділяють їх у агарозному
гелі, переносять на
мембрану, після чого
ідентифікують
специфічні ділянки з
допомогою гібридизації з
олігонуклеотидними
зондами.
Nothern Blotting
Аналог Southern Blotting.Цей метод дозволяє виявити специфічну
мРНК та оцінити її розмір.
Eastern Blotting (є продовженням методу Вестерн блот)
Визначення методу Вестерн Блоттінг
Метод заснований накомбінації гельелектрофорезу та
імунохімічної
реакції «антигенантитіло».
"Тверда фаза" для імуноблоту
пористі матеріали типунітроцелюлози (PVDF) у вигляді
наповнювачів в обсязі або у вигляді
плоских листів або смужок стрипів
(англ. strip); стрипи використовують у
методиках типу імуноблоту та
імунохроматографії;
у пористих матеріалах суттєво
більше площа, на якій
сорбований один із учасників
взаємодії; інші реагенти
дифундують по порах.
Типи твердої фази для Вестерн блот
Підготовка зразка
Зразок може бути взятий із цільноїтканини або з клітинної культури. Цілісна тканина
Клітинна культура
більшості випадків, тверді тканини
спочатку подрібнюються механічно
з використанням блендера (для
зразків великого обсягу), з
Механічне подрібнення
використанням гомогенізатора
(менші обсяги), або
обробки ультразвуком
Різні детергенти, подрібнення гомогенізатором
солі та буфери можуть бути
застосовані для
поліпшення лізису клітин та
розчинення білків.
Обробка ультразвуком
Інгібітори протеаз і фосфатаз
про додаються для запобігання
розщеплення зразків їх
Подрібнення у рідкому азоті
власними ферментами.
Підготовка тканин часто
виконується за низьких
температурах, щоб
Інгібітори протеаз, фосфатаз
уникнути денатурації білка.
Умови, що покращують
пробопідготовку
Детергенти, солі, буфери
виробляє гомогенізацію зразків за рахунок їх струшування.
у мікропробірках або чашах разом із твердими кульками
Низькі температури
Гель-електрофорез. Найбільш поширений спосіб поділу білків - електрофорез у поліакриламідному гелі у присутності SDS за Леммі
Гель-електрофорез. Найбільшпоширений спосіб
поділу білків -
електрофорез у
поліакриламідному гелі в
присутності SDS за Леммі
Гель-електрофорез
Гель-електрофорезSDS викликає
денатурацію білків
і підтримує їх у
денатурованому
стані, для
руйнування
вторинних та
третинних структур
білків використовують
відновники
дисульфідних
зв'язків
Гель-електрофорез
Що підлягаютьаналізу білки в
присутності
додецилсульфату
натрію набувають
однаковий
негативний
заряд, що робить
можливим їх
поділ у
залежності тільки
від молекулярної
Принцип електрофорезу
Попередньоденатуровані білки
вносять до кишень «треків»
(доріжок) акриламідного гелю
з низькою концентрацією
(концентруючий гель), що
дозволяє їх сконцентрувати
перед переходом у
розділяючий гель (з більш
високою концентрацією), де
відбувається поділ білків
залежно від молекулярної
маси.
Білки мігрують у
електричному полі через
акриламідний гель до анода,
при цьому менші білки
розміри рухаються швидше.
Принцип електрофорезу
Відмінності у швидкостіпросування -
електрофоретичної
рухливості призводить до
поділу білків на смуги.
Як правило, одну з
«доріжок» залишають для
маркерів молекулярної маси
(суміші білків з відомими
масами).
Фарбування гелів
фарбування білків угелях барвником
Кумассі
фарбування білків у
гелях сріблом
Для візуалізації результатів електрофорезу частіше
всього використовують фарбування білків у гелях
барвником Кумассі або сріблом
У більшості випадків результати
електрофоретичного поділу достатньо
одержати шляхом візуальної оцінки гелю.
Однак, з метою отримання достовірних даних та
належного документування результатів гель
сканують на просвіт за допомогою високочутливого
денситометра, що дозволяє надійно визначати не
тільки становище білків у гелі, а й оптичну
густина білкової плями.
Фарбування
мембрани більше
надійно
Аналіз електрофоретичного поділу білків, Блоттінг
За допомогою спеціального програмного додаткуможна визначити такі параметри як
електрофоретична рухливість білка, його
чистота, кількість білка у плямі та ін.
Найчастіше використовують хемілюмінесцентну систему
детекції білків – використання рентгенівських плівок
(Блоттінг)
Використовують
програмне
додаток ImageJ
Застосування системи візуалізації для WB (див. нижче)
Аналіз електрофоретичного поділу білків
Визначення молекулярної маси білка, що досліджується.передбачає необхідність калібрування гелю по
молекулярних мас. Калібрують гель відносно
молекулярних мас білків-маркерів, які
розділяють паралельно з досліджуваним зразком.
Вибір % роздільної здатності гелю.
концентраціяакриламіду визначає
вирішальну
здатність гелю - чим
вище концентрація
акриламіду, тим краще
поділ
низькомолекулярних
білків. Низька
концентрація
акриламіда покращує
вирішальну
здатність гельелектрофорезу для
високомолекулярних
Розмір білка, kDa
%AA
36-205
5%
24-205
7.5%
14-205
10%
14-66
12.5%
10-45
15%
Перенесення на мембрану Щоб зробити білки доступними для антитіл і подальшої детекції, їх разом зі смужкою гелю переносять на мембрану
Перенесення на мембрануЩоб зробити білки доступними для антитіл та подальшої детекції, їх разом із смужкою
гелю переносять на мембрану, виготовлену з нітроцелюлози або PVDF.
Мембрана накладається поверх гелю,
а поверх неї кладуть чарку
фільтрувального паперу.
Метод перенесення білків
називається електроблотом і
використовує електричний струм, який
переносить білки із гелю на мембрану.
Білки переміщаються з гелю на
мембрану зі збереженням свого
розташування. В результаті цього
«промокування» (blotting) процесу
білки утримуються на тонкому
поверхневому шарі мембрани для
детекції.
Обидва варіанти мембран використовують через їх властивості неспецифічно пов'язувати
білки.
Зв'язування білків засноване як
на гідрофобних взаємодіях, так
та на електростатичних
взаємодіях між мембраною та
білком.
Нітроцелюлозна мембрана дешевша
PVDF, але набагато тендітніша і гірша
витримує повторне нанесення
міток.
Види електроблоту
СухийВологий
Напівсухий
(Semidry)
Фарбування білків на фільтрі
Спосібзабарвлення
Ponceau S
Чутливість,
кількість
білка
1-2µg
Нітроцелюлоза
+
Нейлон
-
PVDF
+
Amido
Black
1.5µg
+
-
+
Comassie
blue
1.5µg
+
-
+
India ink
100ng
+
-
+
Biotinavidin
30ng
+
+
+
Colloidal
gold
3ng
+
-
+
Фарбування
оборотне
постійне, низьке тло
постійне, високе тло
постійне
постійне, блідне зі
часом
постійне
Підтвердження перенесення білків на фільтр (забарвлення Ponceus)
Блокування
Як тільки обраномембрана, вибрані антитіла
і цільовий білок, повинні
бути вжиті заходи
виключення взаємодії
між мембраною та
антитілом, що використовується для
детекції цільового білка (бо
антитіло саме собою білок).
Блокування
неспецифічних зв'язувань
досягається приміщенням
мембрани в розведений
розчин білка – зазвичай це
бичачий сироватковий
альбумін або нежирне
сухе молоко чи желатин
з невеликим відсотком
детергенту типу Tween-20.
Блокування - один з
важливих етапів
проведення
ефективного Вестерн
блоттингу
Механізм блокування
Білокз розведеного
розчину прикріплюється до
мембрані у всіх місцях,
де не прикріпився цільовий
білок. Тому, при
додаванні антитіл, ім
(антитілам) немає вільного
місця на мембрані, куди б
вони могли прикріпитися,
крім сайтів зв'язування на
специфічних цільових
білки. Цей фоновий
"шум" в остаточному
продукті вестерн блота
призводить до чистих
результатам та
виключення помилково-
Детекція. Непрямий та прямий WB
перевагиВторинне антитіло посилює сигнал (декілька вторинних
антитіл можуть зв'язуватися з одним первинним)
Є широкий вибір вторинних антитіл
Одне вторинне антитіло може бути використане для
детекції різних специфічних антитіл
зв'язування з ферментативною міткою вторинного антитіла не
впливає на імунореактивність первинного антитіла
Заміна вторинного антитіла може сприяти зміні
методу детекції
недоліки
Вторинні антитіла сприяють утворенню сайтів
неспецифічного зв'язування
Додаткові етапи роботи
переваги
необхідність використовувати тільки
первинні антитіла, що прискорює процес
можливість використовувати первинні
антитіла з різними мітками
Недоліки
зв'язування з ферментативною міткою
може знижувати імунореактивність
первинного антитіла
висока вартість первинних антитіл
проблема вибору антитіла та низький
сигнал
Детекція. Наступним етапом є реакція зв'язування білка, що досліджується, зі специфічним антитілом (первинним).
Розчин антитіл та мембранаможуть бути разом закриті та
інкубовані від 30 хвилин
до залишення проти ночі.
Також вони можуть бути
інкубовані при
різних температурах,
при підвищеній
температурі спостерігається
найкраще зв'язування.
Після видалення
первинних, що не зв'язалися
антитіл, мембрану
витримують із вторинними
антитілами та відповідно
з їх цільовими властивостями,
як правило називаються по
Антитіла для вестерн блот. Механізм детекції.
Антитіла отримують зтваринного джерела та
зв'язуються з
більшістю первинних
антитіл. Вторинні
антитіла зазвичай пов'язують
лужною фосфатазою або
пероксидазою хрону.
Найбільш
поширені,
пов'язані з пероксидазою
хрону вторинні антитіла
використовуються для
розрізання
хемілюмінесцентного
агента, і продукт реакції
виробляє люмінесцентне
випромінювання пропорційно
кількості білка.
Лист світлочутливий
фотографічної плівки
поміщається навпроти мембрани
та піддається дії
випромінювання реакції, створюючи
зображення смуг антитіл на
блоті.
Дешевший, але менш
чутливий підхід з
використанням 4хлорнафтольного фарбування
у суміші з 1% перекисом
водню, що дає темно-коричневе фарбування,
яке реєструється без
використання спеціальної
фотографічної плівки.
Інший метод детекції
вторинними антитілами
використовує антитіла зі
пов'язаним флюорофором,
який випромінює в
ближньої інфрачервоної
області (NIR). Світло,
випромінюваний
флюоресцентним
барвником, постійний та
робить флюоресцентну
детекцію більш точним та
чутливим способом
вимірювання різниці в
сигнал, що виробляється
білками, що мічені
антитілами, на вестерн
блоті.
Детекція. Інші методи детекції.
Третій альтернативнийметод використовує
радіоактивну мітку
замість ферменту,
пов'язаного з вторинним
антитілом (з
радіоактивним ізотопом
йоду). Інші методи
безпечніше, швидше та
дешевше, тому
радіоактивна детекція
використовується рідко.
Візуалізація.
Візуалізаціяздійснюється з
допомогою гельдокументуючих
систем або цифровий
камерою.
Подання фільму
Stain free technologyНа практиці, не у всіх
вестернах виявляють
білки лише по одному бенду
на мембрані.
Приблизний розмір
обчислюють порівнюючи
пофарбовані бенди з
маркерами молекулярною
маси, доданими при
електрофорез.
Процес повторять з
структурними білками,
такими як актин або
тубулін, які не
змінюють між
експериментами. Кількість
цільового білка залежить від
кількості контрольного
структурного білка між
групами. Цей прийом
забезпечує корекцію
кількості загального білка на
мембрані у разі помилки
Аналіз та подання результатів.
Використанняпрограмного
програми Image
J.
Програмного
додаток BioRad ІДГ
Імунна
флюоресценція
Вестерн
блоттинг
Застосування методу
Вестерн-Блоттінгвикористовується
у молекулярній
біології, біохімії, гені
тиці та в інших
природничо-наукових
дисциплін.
В медицині:
діагностика ВІЛ
(СНІД), хвороба
лайма,Helicobacter
Pylori, вірус ЕпштейнБарр
Повний протокол
1. електрофорез2. перенесення
3. блокування
4. інкубація з
первинним антитілом
5. відмивання
6.інкубація зі
вторинним антитілом
7. відмивання
8. обробка
хемілюмінесцентної
системою детекції
9. детекція за допомогою
рентгенівської плівки
10. аналіз
Застосування у практичній медицині
Підтвердженняінфікованості ВІЛ
Діагностика кліщового
бореліозу (хвороба Лайма)
Діагностика сибірки
Діагностика токсоплазмозу
(Т);
групу інфекцій –
гепатити, сифіліс,
хламідіоз, листериоз та ін.
(О);
краснуху (R);
цитомегаловірусну
інфекцію (С);
Герпес (Н).
Вірус Епштейн-Барр
В цьому випадку на тестові стрип-мембрани нанесено
тільки
клінічно
значущі
антигени
(нативні,
синтетичні або рекомбінантні) у певному
порядку. Такий підхід використовують для диференціальної
діагностики кількох інфекцій на одному стрипі
Загальні.
1) перенесення білка з гелю на мембрану;
2) забиття неспецифічної сорбції;
3) адсорбція I-антитіл;
4) відмивання;
5) адсорбція II-антитіл;
6) відмивання;
7) прояв фільтру;
По пунктам.
Гібридизація.
- Все робити при NT на платформі, що гойдається, гібридизація і забиття в целофанових пакетах (V розчину ~1.5мl, в залежності від розміру фільтра), відмивання у ванночці:
- забивання: 3% сухе молоко, 1х PBS, 30-40";
- "I"а/т: 1h 0.3% сухе молоко, 1х PBS, антисироватка;
- відмивання 3 рази х 5": 1х PBS, 0.05% Tween-20;
- "II"а/т: 30" в 1х PBS;
- відмивання як у п.3.
- Відмивання та забиття проводяться у ванночці. Гібридизація: на стіл покласти шматок парафільму (більше за мембрану), на нього - 0.5-1ml гібридизаційного розчину з а/т. Покласти мембрану стороною (Р) до розчину, уникаючи бульбашок, зверху прикрити шматком парафільму розміром з мембрану. Інкубувати 1h.
Незважаючи на суттєво нижчий вміст сухого молока в гібридизаційному буфері для "I"а/т і повна його відсутність у буфері для "II"а/т цей метод давав чисті картинки. Мабуть, успіх визначався якістю використаних а/т.
Цей спосіб скорочує обсяг гібридизаційної суміші, але може погіршити якість гібридизації.
- Вконтакте 0
- Google+ 0
- ОК 0
- Facebook 0